RFID y Data Matrix en la industria farmaceútica

El proyecto que pretende certificar la autenticidad de los medicamentos de la Unión Europea, consensuado por la patronal de la distribución farmacéutica (GIRP), de la industria farmacéutica (Efpia) y de la oficina de farmacia (PGEU), progresa de manera positiva y a buen ritmo según informan algunos de sus representantes en el congreso Infofarma 2011 que se celebró en Castellón y en el que cooperó la Sociedad Española de Informática de la Salud (SEIS). Conforme explicó el director técnico de Farmaindustria, Emili Esteve, 2013 era la fecha indicada para que se concretase el mecanismo necesario para la verificación de los medicamentos en la Unión Europea por parte de los actos delegados.
A partir de la fecha dada, los estados tuvieron tres años más para poder ejecutarlo, lo que significaba que en 2 años (2017), los países miembros tendrían un método de comprobación de los fármacos.
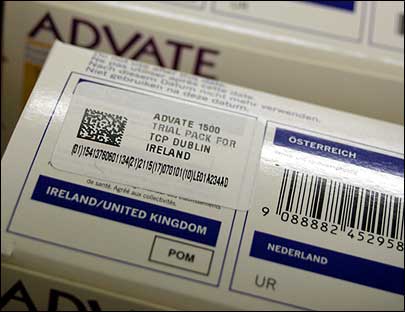
El director general de Fedifar y vicepresidente del GIRP, Miguel Valdés, aclaró que a mediados del 2012 se enviaría a la Comisión Europea aquel texto que las tres importantes patronales estaban consensuando y que se apoyaba en un sistema de autentificación con el método denominado “Datamatrix”, una manera transparente y eficiente en el que cada generador de datos es el único propietario y administrador de dicha información.
Según dijo Esteve, se trataba de un modelo “end to end” que exceptúa al mayorista de realizar el seguimiento de cada envase, aunque podrá revisar, cuando lo crea necesario y lo necesite, si un producto es auténtico o por el contrario, no lo es.
Sin embargo, sería un sistema que ayudaría a detectar que los fármacos que ofrece la farmacia son auténticos, cosa que, según Vicente Hernández, representante de la Farmacia de la SEIS, era algo urgente y necesario. “Ya estamos detectando muchos medicamentos que intentan colarse en el sistema legal, por lo que preocupa que los tiempos que ha puesto la Comisión sean suficientes”, destacó.
¿Cómo respondió España ante esto?
La duda estaba en la decisión que tomaría nuestro país en esta materia. La administración centró sus esfuerzos en el desarrollo de los sistemas RFID y Data Matrix.
El gerente de Sadiel, José Candel, matizó la eficiencia general de los dos métodos tanto en farmacia como en laboratorio. No obstante, fallaba su inviabilidad en la operativa de los mayoristas.
Si a todo ello le añadimos la etapa de crisis por la que pasaba y sigue pasando el sector farmacéutico, los expertos esperaban que el Ministerio de Sanidad se consiguiera sumar a lo que llegue de Europa.
Donde sí se debería hacer hincapié, según Esteve, sería en conseguir que estos productos estén vigilados por el proyecto europeo.
“Europa dice que, en un principio, afectaría a todos los medicamentos con receta que tienen más riesgo de falsificación y algunos OTC”, aclaró.
Por su parte, Sergio Marco, del COF de Castellón, dijo que “dado que el Ministerio tendrá que reglamentar la directiva, sería óptimo que obligue a que los que no dispongan de receta estén incluídos también”.
Desde su punto de vista, la comprobación de la autenticidad de los medicamentos es la clave fundamental para la oficina de farmacia.